Terpenbiosynthese in Pflanzen: Synergien der Organellen
Jara M. Al-Mousawi, Manish L. Raorane
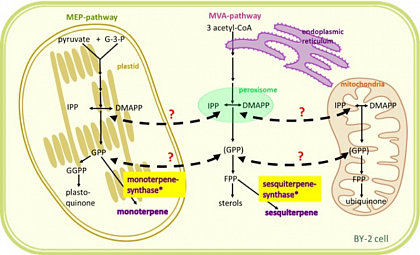
Obwohl bisher angenommen wurde, dass durch die jeweiligen Terpen-Biosynthesewege in unterschiedlichen Kompartimenten stattfinden, haben neuere Studien eine komplexe Interaktion (“Crosstalk”) zwischen diesen beiden Biosynthesewegen gezeigt.Dieser Crosstalk wurde mit der Biosynthese verschiedener Isoprenoidklassen in Verbindung gebracht.Trotz der wachsenden Anerkennung dieses Phänomens bleiben die genauen Mechanismen des Isoprenoidtransports zwischen den Organellen unklar. Während Prenyldiphosphate als mögliche Kandidaten vorgeschlagen wurden, fehlen definitive experimentelle Beweise für ihre Translokation über Organellenmembranen.
Darüber hinaus wurde die subzelluläre Lokalisation des MVA-Weges auf das endoplasmatische Retikulum und das Peroxisom erweitert, was die klassische zytosolische Sichtweise in Frage stellt. Die dynamische Architektur von Pflanzenorganellen, gekennzeichnet durch Strukturen wie Stromule, Matrixule und Peroxule, bietet einen möglichen Rahmen für verbesserte Interorganellenkommunikation. Wir postulieren, dass diese Organellenverlängerungen den Austausch von Isoprenoid-Zwischenprodukten erleichtern.
Um diese Hypothese zu untersuchen, verwenden wir Tabak BY-2-Suspensionszellen als Modellsystem. Unser Ansatz umfasst drei Schlüsselstrategien:
- Überexpression von Terpensynthase Genen in spezifischen Organellen, um metabolischen Crosstalk zu induzieren.
- Einsatz chemischer Elicitoren und fluoreszierender Protein-Tags, um Organelleninteraktionen und -dynamiken zu visualisieren.
- Verwendung markierter 13C-Zucker, um den Isoprenoidweg-Crosstalk zu quantifizieren.
Durch die Erforschung der Regulationsmechanismen der Isoprenoidbiosynthese möchten wir somit neuartige Angriffspunkte identifizieren für weiteres metabolic engineering.